Catalizadores de metales preciosos: El amplificador del rendimiento - El soporte
Capítulo 1: Introducción
Un catalizador de metal precioso es un material que puede alterar la velocidad de una reacción química sin consumirse en los productos finales. Aunque casi todos los metales preciosos pueden servir como catalizadores, los más utilizados son el platino, el paladio, el rodio, la plata y el rutenio, siendo el platino y el rodio los que tienen aplicaciones más amplias. Sus orbitales d-electrónicos parcialmente llenos adsorben fácilmente reactivos en la superficie con una fuerza de enlace moderada, facilitando la formación de "compuestos activos" intermedios y garantizando así una elevada actividad catalítica. Junto con propiedades superiores como la resistencia a altas temperaturas, a la oxidación y a la corrosión, se han convertido en uno de los materiales catalíticos más importantes.
Los catalizadores de metales preciosos son indispensables en numerosos campos clave debido a su excepcional actividad catalítica y selectividad. En la recuperación del medio ambiente, se utilizan ampliamente en los sistemas de purificación de gases de escape de automóviles y en los procesos de combustión industrial para convertir eficazmente contaminantes tóxicos como el monóxido de carbono, los óxidos de nitrógeno y los compuestos orgánicos volátiles en gases inocuos, reduciendo considerablemente las emisiones. También desempeñan un papel vital en otras áreas de protección medioambiental, como la purificación del aire y el tratamiento de aguas residuales. En la producción industrial, son fundamentales para la síntesis química, ya que mejoran la velocidad de reacción y la selectividad de los productos mediante reacciones catalizadas como la hidrogenación, la oxidación y la carbonilación. Además, en el sector energético de vanguardia, los catalizadores de metales preciosos son la piedra angular de las tecnologías energéticas del hidrógeno, ya que forman parte integrante de la producción de hidrógeno, el funcionamiento de las pilas de combustible y el almacenamiento de hidrógeno, lo que permite avanzar en la conversión y utilización de energías limpias.
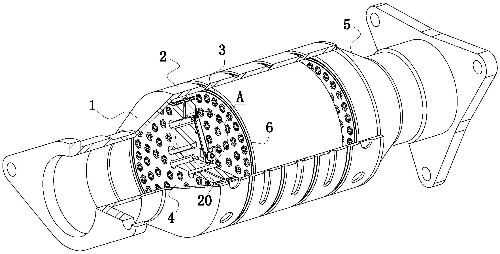
Fig. 1 Esquema estructural de un catalizador de tres vías para automóviles
Sin embargo, los inconvenientes inherentes a los metales preciosos -su escasez mundial, su elevado coste y su susceptibilidad a la desactivación por sinterización, lixiviación y envenenamiento- limitan seriamente su aplicación comercial a gran escala. La clave para resolver estos problemas no está en los metales preciosos en sí, sino en su "base": el soporte. La ciencia catalítica moderna revela que el soporte dista mucho de ser un andamiaje físico inerte; es una plataforma multifuncional y un socio sinérgico crucial para superar las limitaciones de los metales preciosos. Su valor fundamental se manifiesta en dos aspectos clave:
El soporte, con su elevada superficie específica y abundantes defectos superficiales, proporciona "sitios de anclaje" seguros para nanopartículas de metales preciosos o incluso átomos individuales, lo que permite la dispersión a nivel atómico. Esto no sólo maximiza la exposición de los sitios activos, mejorando significativamente la eficiencia de utilización atómica, sino que también previene eficazmente la migración y aglomeración (sinterización) de partículas a altas temperaturas a través de restricciones espaciales físicas y fuertes interacciones, mejorando fundamentalmente la estabilidad del catalizador.
Existen profundas interacciones entre el soporte y el metal precioso. A través de efectos electrónicos (por ejemplo, interacciones fuertes metal-soporte, SMSI), el soporte puede modular la densidad de la nube de electrones del metal precioso, optimizando su fuerza de adsorción para los reactivos, mejorando así la actividad catalítica intrínseca y la selectividad. Además, la acidez/basicidad superficial inherente o las propiedades redox del soporte pueden catalizar sinérgicamente reacciones con los sitios activos del metal precioso, posibilitando vías de reacción complejas inalcanzables por componentes individuales, construyendo colectivamente sistemas catalíticos bifuncionales eficientes.
Capítulo 2: Funciones básicas y mecanismos del soporte
En el diseño de catalizadores de metales preciosos, el soporte no es un mero recipiente pasivo de reacción, sino un componente clave que desempeña múltiples funciones activas. Sus mecanismos funcionales influyen profundamente en el rendimiento final del catalizador, evidenciándose principalmente en cuatro áreas:
1. 1. Dispersión y estabilización
La función principal del soporte es actuar como "anclaje" de las nanopartículas de metales preciosos. Una superficie específica elevada (por ejemplo, cientos de m2/g) proporciona numerosos sitios de carga, lo que permite que el metal precioso esté muy disperso a escala nanométrica o incluso atómica, maximizando así la exposición de los sitios activos y mejorando la eficiencia de utilización atómica. Sin soporte, las nanopartículas de metales preciosos, debido a su elevada energía superficial, migran, se aglomeran y se sinterizan fácilmente a temperaturas elevadas, lo que provoca una drástica reducción de la superficie activa y la desactivación. Además, las estructuras porosas de muchos soportes pueden crear un efecto de confinamiento, restringiendo las partículas metálicas dentro de nanocavidades o capas intermedias -como si se tratara de "nanorreactores"-, lo que dificulta físicamente su movimiento y crecimiento, aumentando aún más la estabilidad térmica.

Fig. 2 Materiales porosos
2. Efectos electrónicos
Existen profundas interacciones electrónicas entre el soporte y el metal precioso, entre las que destaca la fuerte interacción metal-soporte (SMSI). Tomando como ejemplo el sistema Pt/TiO2, tras un tratamiento de reducción a alta temperatura, parte del Ti4+ de la superficie del TiO2 se reduce y migra para cubrir la superficie de las nanopartículas de Pt, formando una subcapa de óxido. Este proceso va acompañado de una transferencia de electrones del TiO2 al Pt, lo que altera la densidad de la nube de electrones del Pt y, en consecuencia, modula su fuerza y modo de adsorción para las moléculas reactivas (por ejemplo, CO, O2). Este "control remoto" a través de efectos electrónicos puede mejorar significativamente la actividad catalítica y la selectividad para reacciones específicas e incluso conferir resistencia al envenenamiento.
3. Catálisis sinérgica
Muchos soportes no son inertes; sus superficies poseen sitios ácidos/básicos o sitios catalíticamente activos inherentes, lo que permite una catálisis sinérgica con el metal precioso, constituyendo un mecanismo "bifuncional". Por ejemplo, en el reformado catalítico en el refinado del petróleo, el Pt del catalizador Pt/γ-Al2O3 es responsable de la hidrogenación/deshidrogenación de olefinas, mientras que los sitios ácidos de la superficie γ-Al2O3 facilitan la isomerización de carbocationes; las dos funciones trabajan juntas para reconstruir las moléculas de hidrocarburos. Otro ejemplo se encuentra en las reacciones anódicas de las pilas de combustible, donde las especies RuOH en los catalizadores PtRu/C promueven la activación del agua, proporcionando especies OH a los sitios adyacentes de Pt para oxidar el CO, resolviendo el problema del envenenamiento del catalizador de Pt por el CO.
Fig. 3 Catálisis cooperativa molécula orgánica pequeña/metal
4. Transferencia de masa y calor
La estructura física del soporte determina la eficiencia del transporte de reactivos y productos. El ajuste preciso de la estructura porosa (incluyendo el tamaño de los poros, el volumen de los poros y la conectividad) optimiza las velocidades de difusión, evitando pérdidas de eficiencia de reacción debidas a limitaciones en la transferencia de masa. Los macroporos favorecen una rápida transferencia de masa, los mesoporos son adecuados para cargar nanopartículas y facilitar las reacciones, y los microporos pueden permitir la selectividad de formas. Al mismo tiempo, los soportes excelentes poseen una gran estabilidad térmica y conductividad térmica, lo que les permite soportar entornos de reacción exotérmica a alta temperatura, eliminar rápidamente el calor de reacción y evitar el colapso de la estructura del catalizador y la sinterización del componente activo causados por el sobrecalentamiento local.
Capítulo 3: Principales tipos de soportes para catalizadores de metales preciosos y sus características
1. 1. Soportes de óxido
Los soportes de óxido constituyen la categoría más ampliamente estudiada y aplicada.
γ-Al2O3: Conocido como el "soporte caballo de batalla", sus ventajas incluyen una elevada superficie específica, una acidez superficial adecuada y una buena resistencia mecánica. Estas propiedades lo hacen ideal para catalizadores de tres vías de automoción (carga de Pt, Pd, Rh) y catalizadores de hidrodesulfuración (carga de Pd).
SiO2: Típicamente posee una superficie neutra y una elevada superficie específica. Su inercia superficial significa que no interfiere con la actividad intrínseca del metal precioso. El SiO2 mesoporoso sintonizable puede prepararse mediante métodos de templado y se utiliza ampliamente en reacciones selectivas de hidrogenación y oxidación.
TiO2: Más allá de su elevada superficie específica, su característica más significativa es la capacidad de formar fuertes Interacciones Metal-Soporte (SMSI) con metales preciosos, mejorando notablemente el rendimiento catalítico. Al mismo tiempo, el TiO2 es un excelente semiconductor fotosensible; cuando se combina con Au, Pt, etc., muestra un gran potencial en fotocatálisis para la división del agua y la degradación de contaminantes.
CeO2: Posee una capacidad única de almacenamiento de oxígeno (OSC), lo que le permite cambiar rápidamente entre atmósferas oxidantes y reductoras a través del ciclo Ce4+/Ce3+, regulando eficazmente la concentración de oxígeno en el entorno de reacción. Esta característica lo hace indispensable en la purificación de gases de escape de automóviles (como co-catalizador) y en reacciones relacionadas con la redox.
Tabla 1: Comparación de las principales características de los soportes de óxido
|
Tipo de soporte |
Superficie específica |
Propiedad superficial |
Características clave |
Aplicaciones típicas |
|
γ-Al2O3 |
Alto |
Débilmente ácido |
Alta resistencia mecánica, buena estabilidad térmica |
Limpieza de gases de escape de automóviles, hidrotratamiento |
|
SiO2 |
Alto |
Neutro |
Tamaño de poro ajustable, superficie inerte |
Hidrogenación selectiva, oxidación |
|
TiO2 |
Medio |
Anfótero |
SMSI, Actividad fotocatalítica |
Fotocatálisis, oxidación de CO |
|
CeO2 |
Medio |
Básico |
Excelente capacidad de almacenamiento de oxígeno |
Catalizadores de tres vías, reacción de cambio agua-gas |
2. Soportes de materiales de carbono
Los materiales de carbono destacan por su conductividad y diversidad estructural.
Carbón activado: Presenta una superficie específica extremadamente alta y abundantes grupos funcionales superficiales (por ejemplo, -OH, -COOH), lo que facilita su modificación y la carga de metales. Debido a su bajo coste, se utiliza ampliamente en reacciones en fase líquida (por ejemplo, hidrogenación química fina) y electrocatálisis.
Nanotubos de carbono/Grafeno: Estos nuevos materiales de carbono poseen una estructura única de carbono hibridizado sp², una conductividad extremadamente alta y canales de poros regulares. No sólo inducen efectos electrónicos con metales preciosos a través de la conjugación π-π, sino que también garantizan una rápida transferencia de electrones durante la electrocatálisis debido a su excepcional conductividad, demostrando así un rendimiento excepcional en campos como las pilas de combustible (por ejemplo, Pt/CNTs para la reducción de oxígeno) y la electrólisis del agua.
3. Soportes de zeolita
Las zeolitas son aluminosilicatos cristalinos caracterizados principalmente por sus sistemas de canales microporosos ordenados y su acidez sintonizable.
Selectividad de forma: El tamaño de sus poros a escala molecular (normalmente <2 nm) permite el paso selectivo de reactivos y productos en función del tamaño y la forma, lo que posibilita la catálisis selectiva por forma. Por ejemplo, en el hidroacabado de gasóleo catalizado por Pt/zeolita, los alquenos de cadena recta pueden hidrogenarse selectivamente mientras que los alcanos ramificados se retienen.
Fuerte acidez y efecto de confinamiento: Sus fuertes centros ácidos, combinados con el confinamiento de las partículas metálicas dentro de microporos, hacen que destaquen en reacciones como la isomerización de alcanos y la aromatización.
4. Otros soportes novedosos
Con los avances en nanotecnología, hay una serie de soportes novedosos que muestran un gran potencial.
Estructuras metal-orgánicas (MOF): Compuestos de iones metálicos y enlazadores orgánicos, presentan una superficie específica ultraelevada y entornos de poros atómicamente diseñables, lo que los convierte en plataformas ideales para lograr la dispersión de metales preciosos en un solo átomo y la catálisis selectiva por tamaño.
Materiales mesoporosos: Como el SBA-15 y el MCM-41, presentan estructuras mesoporosas muy ordenadas y distribuciones de tamaño de poro estrechas, que proporcionan canales ideales para la transferencia de masa y las reacciones de moléculas grandes, resolviendo los problemas de transferencia de masa lenta de los materiales microporosos.
Carburos/Nitruros: Al igual que el carburo de molibdeno y el nitruro de carbono, presentan una conductividad similar a la de los metales, una gran estabilidad química y estabilidad térmica. Como soportes electrocatalizadores emergentes o catalizadores sinérgicos, muestran potencial para sustituir a los soportes tradicionales.
Tabla 2: Comparación de las características de otros tipos de soporte
|
Tipo de soporte |
Característica estructural |
Ventaja principal |
Aplicaciones potenciales |
|
Zeolitas |
Microporosas cristalinas |
Selectividad de forma, fuerte acidez |
Hidrogenación selectiva por forma, isomerización, tamizado molecular |
|
MOFs |
Cristalino Poroso |
Superficie ultraelevada, estructura diseñable |
Catálisis de átomo único, almacenamiento/separación de gases |
|
Materiales mesoporosos |
Mesoporos ordenados |
Tamaño de poro uniforme, alta eficiencia de transferencia de masa |
Catálisis de moléculas grandes, biosensores |
|
Carburos/Nitruros |
Compuestos intersticiales |
Alta conductividad, alta estabilidad |
Electrocatálisis, catálisis resistente a la corrosión |
Capítulo 5: Retos y perspectivas de futuro
Los catalizadores de metales preciosos, aunque indispensables, se enfrentan a importantes obstáculos que impulsan la investigación en curso. El principal reto sigue siendo su elevado coste y su escasez natural, que crea vulnerabilidades económicas y en la cadena de suministro para aplicaciones a gran escala como la catálisis en automoción y la producción de productos químicos a granel. A esto se suma su tendencia inherente a desactivarse, principalmente por sinterización -en la que las nanopartículas se aglomeran en partículas más grandes y menos activas a temperaturas elevadas- y por envenenamiento por subproductos de reacción. Además, el rendimiento de estos catalizadores suele verse limitado por los materiales de soporte tradicionales, que funcionan como meros andamios pasivos y no mejoran o estabilizan activamente el metal precioso. Un reto científico más profundo reside en el conocimiento incompleto de los cambios dinámicos en los sitios activos en condiciones reales de funcionamiento y de las relaciones precisas estructura-actividad, lo que dificulta el diseño racional.
El progreso futuro está estrechamente ligado a estrategias innovadoras que maximicen la eficacia y la durabilidad. Un aspecto central es la maximización de la eficiencia de la utilización atómica. Esto implica ir más allá de la simple dispersión de nanopartículas y pasar a arquitecturas avanzadas como los catalizadores de átomo único (Single-Atom Catalysts, SAC), que teóricamente pueden alcanzar el 100% de dispersión metálica, y sofisticadas estructuras core-shell o nano-frame que concentran átomos preciosos en la superficie donde se producen las reacciones. La estrategia de "extracción de átomos", por ejemplo, demuestra cómo puede utilizarse el diseño de aleaciones para extraer átomos de metales preciosos del núcleo de una nanopartícula a su superficie, lo que aumenta drásticamente la eficiencia al tiempo que minimiza la carga.
Al mismo tiempo, se está redefiniendo el papel del soporte, que pasa de ser un espectador pasivo a un socio activo y sinérgico. El futuro está en el diseño de soportes inteligentes capaces de un control electrónico y geométrico preciso. Esto incluye la ingeniería de Interacciones Metal-Soporte Fuertes (SMSI) para optimizar las propiedades electrónicas y el uso de materiales novedosos como las Estructuras Metal-Orgánicas (MOF) o los Hidróxidos Dobles en Capas 2D (LDH) que ofrecen entornos atómicamente definidos para estabilizar los átomos metálicos. El concepto de efectos de confinamiento, por el que las partículas metálicas quedan físicamente atrapadas en estructuras porosas, es un poderoso método para evitar la sinterización.
El paradigma de desarrollo está pasando del descubrimiento empírico al diseño racional. La integración del aprendizaje automático, la computación de alto rendimiento y la caracterización avanzada in situ está acelerando el descubrimiento de nuevos materiales y nuestra comprensión de los mecanismos catalíticos. Junto a la optimización del uso de metales preciosos, la búsqueda a largo plazo de catalizadores con bajo contenido en PGM (metales del grupo del platino) y, en última instancia, sin PGM, basados en metales de transición que abundan en la Tierra, sigue siendo un camino crítico, aunque difícil, hacia la catálisis sostenible. Estos esfuerzos combinados pretenden romper los tradicionales equilibrios entre actividad, estabilidad y coste.

Fig. 4 Nanotecnología del futuro
Capítulo 6: Conclusión
En resumen, el soporte desempeña múltiples funciones en los catalizadores de metales preciosos que van mucho más allá del mero andamiaje físico. Es la piedra angular para conseguir una alta dispersión, una alta estabilidad y una alta eficiencia de utilización de los metales preciosos, y es clave para mejorar activamente el rendimiento catalítico mediante efectos electrónicos y sinérgicos. Frente a los principales retos que plantean la escasez y la inestabilidad de los metales preciosos, la dirección futura está clara: pasar de la selección empírica tradicional al diseño racional preciso. Mediante la construcción de catalizadores de un solo átomo, estructuras de concha central y el desarrollo de nuevos soportes multifuncionales, podemos "decorar exquisitamente" los metales preciosos a escala atómica/nano. En última instancia, esto nos permitirá reducir drásticamente el uso de metales preciosos y, al mismo tiempo, mejorar multiplicadamente el rendimiento catalítico y la vida útil, proporcionando la fuerza motriz fundamental para el desarrollo sostenible en las industrias energética, medioambiental y química.
Para obtener soluciones avanzadas de catalizadores de metales preciosos que satisfagan estas demandas cambiantes, póngase en contacto con Stanford Advanced Materials (SAM).
Lectura relacionada:
Envenenamiento de catalizadores de metales preciosos: Causas, problemas y soluciones
La catálisis redefinida: Ventajas del paladio sobre carbono
Referencias:
[1] Bell, A. T. (2003). The Impact of Nanoscience on Heterogeneous Catalysis (El impacto de la nanociencia en la catálisis heterogénea). Science, 299(5613), 1688-1691.
[2] Somorjai, G. A., & Li, Y. (2010). Introduction to Surface Chemistry and Catalysis. Wiley.
[3] Tauster, S. J., Fung, S. C., & Garten, R. L. (1978). Strong Metal-Support Interactions. Group 8 Noble Metals Supported on TiO2. Journal of the American Chemical Society, *100*(1), 170-175.
[4] Cargnello, M., et al. (2013). Control of Metal Nanocrystal Size Reveals Metal-Support Interface Role for Ceria Catalysts. Science, 341(6147), 771-773.

 Bares
Bares
 Cuentas y esferas
Cuentas y esferas
 Tornillos y tuercas
Tornillos y tuercas
 Crisoles
Crisoles
 Discos
Discos
 Fibras y tejidos
Fibras y tejidos
 Películas
Películas
 Escama
Escama
 Espumas
Espumas
 Folio
Folio
 Gránulos
Gránulos
 Panales
Panales
 Tinta
Tinta
 Laminado
Laminado
 Bultos
Bultos
 Mallas
Mallas
 Película metalizada
Película metalizada
 Placa
Placa
 Polvos
Polvos
 Varilla
Varilla
 Hojas
Hojas
 Cristales individuales
Cristales individuales
 Blanco para sputtering
Blanco para sputtering
 Tubos
Tubos
 Lavadora
Lavadora
 Cables
Cables
 Conversores y calculadoras
Conversores y calculadoras
 Escriba para nosotros
Escriba para nosotros
 Dr. Samuel R. Matthews
Dr. Samuel R. Matthews


