Los usos del Vanadio y sus usos según sus estados de oxidación
Este contenido procede de una presentación de la beca 2025 Stanford Advanced Materials College de Addison Boyle.
Introducción
El vanadio forma parte de los metales de transición; su número atómico es 23. Tiene una abundancia en la corteza terrestre en torno al (0,02%) similar a la del zinc.1 A pesar de su abundancia, no recibió mucha atención hasta los últimos 50 años. La investigación demostró que el vanadio podría tener un propósito biológico a través del ion vanadato.2 Existen al menos 6 estados de oxidación diferentes; el vanadio existe principalmente en +3, +4 y +5. Cuando se aísla, cada uno de los estados de oxidación presenta un color diferente. V4+ es azul, V3+ es verde y V2+ es violeta.3 Estas oxidaciones son también las más relevantes para los sistemas biológicos.4
Vanadio en la sangre:
Estos estados de oxidación del vanadio son importantes porque pueden pasar por reacciones redox.4 La estabilidad se basa en la ligación, el disolvente y el pH.2 Biogénicamente, esto significa que hay agentes reductores que podrían convertir el vanadio a estados de oxidación más bajos.4 Este proceso depende del pH, cuando el pH aumenta, los potenciales redox disminuyen.4 Cuando se toma en forma de fármaco, entra en el torrente sanguíneo y entra en los constituyentes del suero sanguíneo.4 La reacción con el vanadio determina la especiación del vanadio.1
En condiciones ligeramente ácidas, el V(III), cuando se forma, se asemeja a los sistemas biológicos existentes.1 El plasma sanguíneo podría tener presentes los agentes reductores que podrían conducir a la estabilización del V(III) permitiendo la formación de especies V(III) 2-hTF.1 Estasespecies se asemejan al Fe(III) 2-hTF, que es reconocido por los receptores celulares.1 Esto puede hacerse cuando el V(III) o el Fe(III) son atraídos por el hTF si el V(IV)O en el plasma sanguíneo está disponible, entonces una reducción a V(III) podría ser favorable por la ganancia de energía.1 La unión del V(III) tiene un logK 20, mientras que si el V(IV)O+2 tiene un logK 13.1 Esta reacción necesita estar en condiciones ligeramente ácidas.1
Se ha visto que otros estados de oxidación del vanadio (V(IV) y V(V) pueden sufrir intercambio de ligandos e interconversión redox.1 Siendo los ligandos de baja masa molecular el lactato y el citrato, y los de alta masa molecular el hTF, la albúmina y la inmunoglobulina G.1 Siendo el hTF el más predominante.1 Al igual que en V(III), V(IV) y V(V) reaccionan bien debido a los residuos de los sitios de unión del Fe(III) del hTF.1 Debido a que el Fe(III) 2-hFT es reconocido por los receptores celulares para la endocitosis.1 Esto podría ser posible para los complejos V(IV) y V(V) también.1 Cuando se incuban V(IV)OSO4 y apo-hTF se muestra que corresponden a hTF.1 También se muestra que la proporción de formación es menor que la de Fe(III) 2hTF.1Se ha visto que los complejos VIVO y VIVO-portador, junto con el V(V) como monovanadato, podrían unirse al holo-hTF, que es el agente transportador dentro de la sangre.1 Lo que significa que el vanadio podría estar presente en el plasma sanguíneo y pasar por endocitosis cuando el holo-hTF entra en las células.1
Vanadato:
Existen 3 tipos principales de reacciones que pueden realizarse con vanadato en química acuosa: reacciones de autocondensación, reacciones de coordinación y reacciones redox.4
Para las reacciones de condensación, los aniones de vanadato son protonados por oligómeros en un entorno ligeramente ácido para hacerlo más favorable.4 Esto es crítico para la función celular debido a cómo el pH afecta a los diferentes orgánulos.4 En las células tumorales se ha demostrado que tienen un pH de orgánulo elevado.4 Esto podría significar que el vanadato podría utilizarse para encontrar las células tumorales con el pH elevado.4 Esto podría hacerse con una serie de oligómeros de vanadato en un entorno ácido.4
Dado que el vanadato tiene similitudes con el fosfato, el vanadato se ha empezado a utilizar en reacciones de coordinación, pero todavía se encuentra principalmente en la fase de tubo de ensayo, lo que significa que la mayoría de las reacciones coordinadas son teóricas.4 El fosfato es importante para los sistemas biológicos y está implicado en muchos sistemas biológicos de reconocimiento y biocatalíticos.1 Donde VO43- tiene similitud estructural y electrónica con PO43- Fig 1. 4 Los complejos de vanadato tienen geometrías trigonal-bipiramidales de 5 coordenadas, que coinciden con los estados de transición de 5 coordenadas que se supone que se forman en la reacción de las enzimas dependientes de fosfato Fig 1. 1 Aunque puede haber ligandos mono- y polidentados, los que se utilizan principalmente son los ésteres de vanadato y los anhídridos de vanadato, debido a su analogía con el fosfato. 4 Con el modelado por ordenador, la mayor parte del vanadato estaba en forma de H2VO4- y HVO42- cuando se excluían las proteínas, cuando se incluían las proteínas, la mayor parte del vanadio estaba unido a la transferrina.4 Cuando el complejo metálico de vanadato está estabilizado por ligandos, esto aumenta la posibilidad de reducción.4 Esto conduce a reacciones de coordinación tendentes a la reducción en sistemas biológicos.4
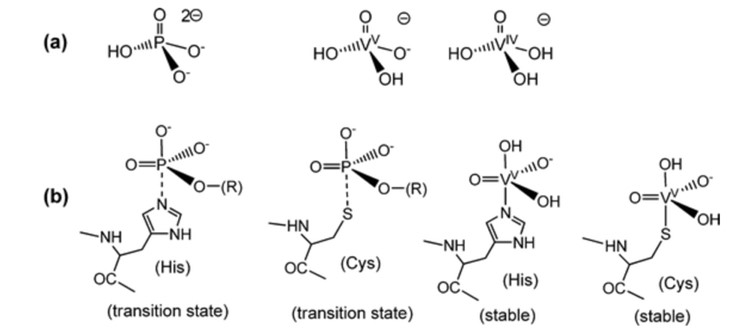
Fig. 1. Comparación de fosfatos y vanadatos con estados de transición y estabilidad.5
En las reacciones redox en sistemas biológicos, los estados de oxidación que importan del vanadio son +3, +4 y +5.4 La mayor parte de la reducción del vanadato es a V(IV) a partir de V(V).4 Este tipo de reacción ocurre en una variedad de biomoléculas, especialmente en orgánulos.4 También se utiliza como tampón para proteínas fosfotirosiladas.4 Esto conduce a la intervención en la vía de señalización de la insulina.4 Puede utilizarse en el tratamiento de la diabetes porque, una vez unido al sitio activo de la enzima, el vanadato no se libera fácilmente como el fosfato.1 Esto bloquea el sitio del fosfato, lo que conduce a una inhibición de la enzima.1 Existen inconvenientes en el uso del vanadato para tratar la diabetes, como el estrés oxidativo inducido por el vanadio, los problemas de toxicidad global, los efectos sobre el sistema inmunitario y la inflamación.1
Investigación del cáncer:
Se han investigado las propiedades del vanadio por sus efectos quimiopreventivos y antitumorales en la lucha contra el cáncer.1 Las pruebas parecen estar principalmente en las fases de experimentación animal y en líneas celulares malignas.1 El dicloruro de vanadoceno y varios peroxovanadatos son los principales compuestos de vanadio que se han utilizado.1 El dicloruro de vanadoceno es soluble en agua, y a un pH de 7 los iones cloruro se sustituyen por H2O, dando lugar a V(C5H5)2]2+.1 Se ha visto que se une al ADN, provocando un comportamiento diferente del cisplatino.1 También ha mostrado una toxicidad limitada, no se transfiere a través de la barrera sanguínea y no se detecta en el cerebro.1 Los objetivos de las propiedades anticancerígenas del vanadio son la alteración del metabolismo celular, las vías de transducción de señales y la alteración de la proliferación celular. 1 Ha habido preocupación por las diversas respuestas y la seguridad del vanadio, lo que ha llevado a una falta de investigación clínica.1 Teniendo en cuenta estas preocupaciones, se sigue investigando.1 Los sistemas V(V)-mhcpe se han probado in vitro y se han obtenido resultados de que son más tóxicos para las células tumorales que para las no tumorales.1 Los complejos V(IV)-que tienen derivados de 1-10-fenantrolina como ligandos y los complejos V(IV)O-dppz han mostrado propiedades anticancerígenas Fig 2, especialmente contra la leucemia.1
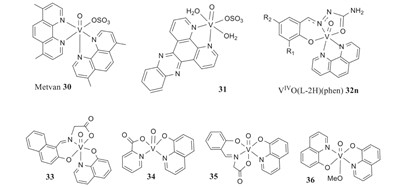
Fig. 2. Representación de las propiedades antitumorales de los compuestos de vanadato, con estabilidad tampón pH 7.1
Amavadin:
Existe un hongo que acumula vanadio llamado Amanita muscaria, o la mosca agárica.6 Una seta típica contiene menos de 0,5 mg de V kg-1, pero A. muscaria puede contener 100 mg V kg-1.6 Las partes del cuerpo de la seta que contienen vanadio son el pie, la piel del sombrero, la carne del sombrero, las branquias, las esporas y el bulbo.6 La mayor concentración de vanadio se encuentra en el bulbo, con 1000 mg V kg-1.6 Esta parte de la seta se encuentra en la parte más baja del pie, por lo que es la más propensa a la contaminación del suelo.6 Al observar la capa superior del suelo, la mediana de vanadio se situó en 60 mg kg-1, con un rango de 1,28 y 537 mg kg-1.6 El vanadio que se encontró en A. muscaria tenía carga negativa y fue denominado amavadin Fig 3 por Bayer y Kneifel.6 Se descubrió mediante espectroscopia de resonancia paramagnética de electrones (EPR) que el estado de oxidación del vanadio era +4.6 Los espectros EPR también indicaron que las diferentes partes del hongo contenían el mismo compuesto amavadin.6 Son 2 ligandos tetradentados mostrados en la Fig 3 que pueden coordinarse al centro de vanadio, creando 2 isómeros que aparecen en mezcla casi igual en amavadin sintético y natural.6
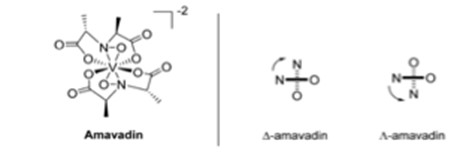
Fig. 3. Estructura de la amavadina, con los isómeros D y L.6
La oxidación de V(IV) a V(V) es reversible en la amavadina, lo que significa que podría tener propiedades catalíticas.6 Se descubrió que el complejo catalizaba una amplia gama de reacciones.6 Esto llevó a sintetizar diferentes análogos de la amavadina con diferentes centros de iones metálicos o ligandos modificados.6 Cuando se sintetizó amavadina a partir de A. muscaria, se descubrió que había diferentes complejos de vanadio, siendo el más destacado el acetato de vanadilo.6 Se encontró un sólido con un 26% (p/p) de acetato de vanadilo y un 74% (p/p) de amavadina.6
Conclusión
En conclusión, se ha demostrado que el vanadio tiene múltiples usos en sistemas biológicos. Desde el tratamiento del cáncer hasta los hongos. La investigación se ha centrado en los diferentes estados de oxidación y en cómo pueden reducirse en sistemas biológicos, como la sangre o las células. Los principales estados de oxidación del vanadio son +3, +4 y +5. Los ligandos que se solían asociar al vanadio eran complejos de oxígeno, especialmente vanadato y acetato de vanadilo. Aún queda mucho por investigar sobre el vanadio y los efectos que tendrá en la comunidad científica.
Referencias:
1. J.Costa Pessoa, Journal of Inorganic Biochemistry, 2015, 147, 4-24
2. A. Butler, y C. J. Carrano, Coordination Chemistry Reviews, 1991, 109, 61-65
3. D. Rehder, Bioinorganic Vanadium Chemistry, Wiley, Incorporated, Nueva York, 2008.
4. X. Yang y K. Wang, en Progress in Molecular and Subcellular Biology, eds. W. E. G. Muller, P. Jeanteur, R. E. Rhoads, D. Ugarkovic y M. R. Custodio. Springer, Manz, Alemania, 2013, cap. 1, pp 1-19.
5. D. Rehder, Metallomics, 2015, 7, 732
6. S. Braeuer, M. Walenta, L. Steiner y W. Goessler, Royal Society of Chemistry, 2021, 36, 954-967.

 Bares
Bares
 Cuentas y esferas
Cuentas y esferas
 Tornillos y tuercas
Tornillos y tuercas
 Crisoles
Crisoles
 Discos
Discos
 Fibras y tejidos
Fibras y tejidos
 Películas
Películas
 Escama
Escama
 Espumas
Espumas
 Folio
Folio
 Gránulos
Gránulos
 Panales
Panales
 Tinta
Tinta
 Laminado
Laminado
 Bultos
Bultos
 Mallas
Mallas
 Película metalizada
Película metalizada
 Placa
Placa
 Polvos
Polvos
 Varilla
Varilla
 Hojas
Hojas
 Cristales individuales
Cristales individuales
 Blanco para sputtering
Blanco para sputtering
 Tubos
Tubos
 Lavadora
Lavadora
 Cables
Cables
 Conversores y calculadoras
Conversores y calculadoras
 Dr. Samuel R. Matthews
Dr. Samuel R. Matthews


