Litio: Elemento Propiedades y Usos
¿Qué es el litio?
¿Qué es el litio?
El litio, de número atómico 3 y símbolo Li, es el metal más ligero de la tabla periódica y un metal alcalino. Durante sus dos siglos de existencia como curiosidad de laboratorio, el litio ha evolucionado hasta convertirse en una materia prima industrial comercializada en todo el mundo. Hoy en día, el refinado y la producción de litio -a través de la electrólisis de la sal o la molienda de minerales como el espodumeno- son la base de una industria multimillonaria en almacenamiento de energía, exploración espacial y electrónica.

Descripción de las propiedades químicas
Las propiedades químicasdel litio son idénticas a sus propiedades físicas:
-Reactividad: El litio reacciona vigorosamente con el agua para formar hidróxido de litio (LiOH) y gas hidrógeno. Por ejemplo, un trozo de litio pequeño sumergido en agua puede desarrollar una efervescencia visible en cuestión de segundos.
-Naturaleza alcalina: Al ser otro metal alcalino, el litio cede fácilmente su único electrón exterior para producir el ion Li⁺, convirtiéndose así en un actor importante en las reacciones electroquímicas, incluso en las baterías de iones de litio.
- Inflamabilidad: El litio se inflama con una llama roja característica, lo que los ingenieros deben tener en cuenta al trabajar y almacenar litio a granel.
Tabla de datos de propiedades físicas
|
Propiedad |
Valor |
|
Número atómico |
3 |
|
Peso atómico |
6,94 g/mol |
|
Punto de fusión |
180.54 °C |
|
Punto de ebullición |
1590 °C |
|
Densidad |
0,534 g/cm³ |
|
Aspecto |
Metal blanco plateado |
|
Dureza |
Blando |
|
Conductividad eléctrica |
Alta |
|
Conductividad térmica |
Alta |
Descubrimiento del litio
El litio se descubrió por primera vez en 1817 en la petalita de una isla de Utö (Suecia). El análisis de Arfvedson reveló un nuevo elemento no identificado con propiedades distintas del sodio o el potasio. El litio metálico se separó posteriormente, mediante electrólisis de sales de litio, para que científicos e ingenieros pudieran analizar más a fondo sus propiedades físicas y químicas. Con el tiempo, la extraña combinación de ligereza, alta reactividad y potencial electroquímico del litio lo situó en una trayectoria que va desde el almacenamiento de energía hasta las grasas industriales y la medicina.
Aleaciones y compuestos de litio
- Aleaciones de litio y aluminio: Extremadamente ligeras y duras, se utilizan en componentes aeronáuticos y piezas de automóviles deportivos.
- Aleaciones de litio-cobre: Mejoran la conductividad eléctrica y se utilizan a menudo en conectores y circuitos electrónicos.
- Fosfato de litio y hierro (LiFePO₄): Común en cátodos de baterías de coches eléctricos debido a su estabilidad y larga vida de ciclo.
- Hidróxido de litio (LiOH) y carbonato (Li₂CO₃): De importancia clave en baterías de recarga, grasas lubricantes y procesos químicos industriales.
- Cloruro de litio (LiCl): Utilizado en desecantes, acondicionadores de aire y síntesis química.
Por ejemplo, Tesla y otros fabricantes de vehículos eléctricos emplean baterías de fosfato de litio-hierro (LFP) en determinadas flotas de automóviles, donde la estabilidad térmica y la densidad energética son primordiales para garantizar la seguridad y la funcionalidad.
Aplicaciones comunes
Existen varias aplicaciones del litio:
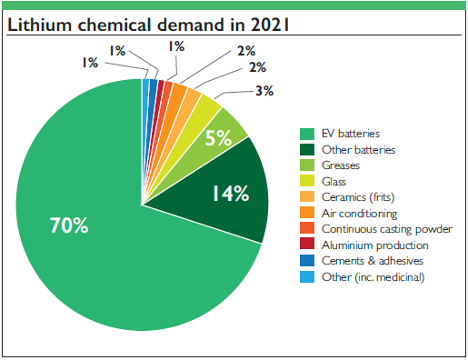
1. Baterías: Las baterías de iones de litio y de polímeros de litio dominan el mercado de la electrónica portátil, los vehículos eléctricos y los sistemas de almacenamiento de energías renovables debido a su alta densidad energética.
2. Aleaciones: El litio aligera las aleaciones de aluminio y cobre, mejorando la eficiencia aeroespacial sin perder resistencia.
3. Usos medicinales: El carbonato de litio estabiliza a los pacientes con trastorno bipolar, lo que demuestra el impacto del litio más allá de los usos industriales.
4. Vidrio y cerámica resistentes al calor: El litio mejora la resistencia al choque térmico y la fuerza.
5. 5. Grasas lubricantes: Las grasas de litio tienen un buen comportamiento a altas temperaturas y presiones, esenciales en la industria manufacturera y del automóvil.
 [1]
[1]
Procesos de preparación
El litio se obtiene principalmente a través de:
1. El litio metálico se recupera a partir de LiCl o LiF mediante electrólisis para obtener una alta pureza para aplicaciones de mercado.
2. 2. Extracción de minerales: El espodumeno y la petalita se procesan para formar carbonato o hidróxido de litio que se utiliza para la producción de baterías y productos químicos.
Preguntas más frecuentes
¿Cuáles son las aplicaciones más frecuentes del litio?
Principalmente en pilas recargables, aleaciones ligeras, grasas lubricantes y productos farmacéuticos.
¿Cómo se extrae el litio?
Por electrólisis de sales de litio o a partir de minerales de espodumeno.
¿Es reactivo el litio?
Sí, sobre todo con el agua, para formar LiOH y gas hidrógeno.
¿Qué son las baterías de iones de litio?
Suministran energía a teléfonos inteligentes, ordenadores portátiles, vehículos eléctricos y sistemas de almacenamiento de energía renovable gracias a su alta densidad energética y larga vida útil.
Referencias:
[1] Asociación Internacional del Litio (2023, 13 de octubre). Litio 101. Obtenido el 17 de julio de 2025, del sitio Web: https://lithium.org/lithium-101/.

 Bares
Bares
 Cuentas y esferas
Cuentas y esferas
 Tornillos y tuercas
Tornillos y tuercas
 Crisoles
Crisoles
 Discos
Discos
 Fibras y tejidos
Fibras y tejidos
 Películas
Películas
 Escama
Escama
 Espumas
Espumas
 Folio
Folio
 Gránulos
Gránulos
 Panales
Panales
 Tinta
Tinta
 Laminado
Laminado
 Bultos
Bultos
 Mallas
Mallas
 Película metalizada
Película metalizada
 Placa
Placa
 Polvos
Polvos
 Varilla
Varilla
 Hojas
Hojas
 Cristales individuales
Cristales individuales
 Blanco para sputtering
Blanco para sputtering
 Tubos
Tubos
 Lavadora
Lavadora
 Cables
Cables
 Conversores y calculadoras
Conversores y calculadoras
 Escriba para nosotros
Escriba para nosotros




 Chin Trento
Chin Trento



