Mejores catalizadores de metales preciosos Pt, Pd y Au: Resolver los cuellos de botella del rendimiento
Resumen
Los catalizadores de metales preciosos son fundamentales para mejorar la eficiencia de los procesos energéticos y químicos debido a su extraordinaria actividad intrínseca. Sin embargo, su aplicación práctica se ve limitada por problemas persistentes relacionados con la actividad, la selectividad, la estabilidad y el coste. Esta revisión aborda sistemáticamente las principales limitaciones de rendimiento de tres destacados catalizadores de metales preciosos -Pt, Pd y Au- y examina las estrategias avanzadas de diseño de materiales ideadas para superar estos problemas. En concreto, nos centramos en:
1) Las arquitecturas de aleación y de núcleo en cáscara en catalizadores basados en Pt para mejorar la actividad de reducción de oxígeno y la durabilidad en pilas de combustible;
2) Configuraciones de átomo único y nanocluster en sistemas basados en Pd para lograr una selectividad superior y resistencia a la sinterización en reacciones de acoplamiento cruzado; y
3) Diseño de soportes y control del tamaño en catalizadores de Au para conseguir una elevada actividad en la oxidación de CO a baja temperatura.
Mediante la comparación de las soluciones adaptadas a estos tres sistemas catalíticos, este trabajo pretende aportar conocimientos interdisciplinarios y guiar el diseño racional de catalizadores de metales preciosos de próxima generación de alto rendimiento, duraderos y rentables.

Fig. 1 Catalizadores de nanometales preciosos
1 Introducción
Los catalizadores de metales preciosos (como el platino, el paladio, el rodio, etc.) son materiales fundamentales en las modernas transiciones industriales y energéticas, y desempeñan un papel central en los sectores del refinado, la síntesis química, el control de emisiones de los automóviles y la energía del hidrógeno. El rápido desarrollo de la industria de las pilas de combustible y del hidrógeno con bajas emisiones de carbono sigue impulsando la demanda de metales del grupo del platino, especialmente en el contexto de un cambio mundial hacia estructuras energéticas más limpias. Las previsiones del sector indican que, para 2030, la capacidad mundial de producción de hidrógeno limpio superará los diez millones de toneladas, lo que consolida aún más la importancia estratégica de los catalizadores de metales preciosos dentro de la cadena de suministro energético.
Sin embargo, la adopción generalizada de catalizadores de metales preciosos sigue enfrentándose a múltiples retos estructurales. La producción anual mundial de metales del grupo del platino es limitada y está concentrada geográficamente, lo que hace que las cadenas de suministro sean muy vulnerables a las tensiones geopolíticas y a la volatilidad del mercado. Para reducir la dependencia de recursos externos, mejorar la eficiencia del reciclado de materiales críticos se ha convertido en una estrategia prioritaria para muchas naciones. En la actualidad, la recuperación de metales preciosos a partir de catalizadores industriales usados se basa principalmente en procesos como la pirólisis, la extracción hidrometalúrgica y la fundición pirometalúrgica. Sin embargo, estos métodos suelen caracterizarse por un elevado consumo de energía y unas tasas de recuperación comprometidas por las impurezas. En el ámbito de la innovación tecnológica, los investigadores están desarrollando alternativas de metales no preciosos y sistemas de disolventes ecológicos para reducir la dependencia de los minerales vírgenes. Al mismo tiempo, las normativas medioambientales, cada vez más estrictas, están impulsando el establecimiento de sistemas de gestión que abarcan todo el ciclo de vida del catalizador -desde la producción y el uso hasta la regeneración-, lo que obliga a la industria a equilibrar la eficiencia de los recursos con la responsabilidad medioambiental.
El diseño estructural de precisión ha surgido como paradigma clave para superar los cuellos de botella en el rendimiento de los catalizadores de metales preciosos. Esta estrategia pretende lograr un control sinérgico de las estructuras electrónicas y geométricas de los sitios activos a escala atómica. En concreto, las técnicas de modulación de la estructura electrónica, como la aleación y la ingeniería de la deformación, optimizan el comportamiento de adsorción de los intermediarios de la reacción, mejorando así la actividad intrínseca. La ingeniería geométrica -como la construcción de átomos individuales, nanoclusters, planos cristalinos específicos o estructuras core-shell- maximiza la densidad y estabilidad del sitio activo. Mientras tanto, la ingeniería de la interfaz de portadores y los efectos de confinamiento espacial permiten guiar con precisión la vía de reacción, superando así los retos del control selectivo y la estabilidad a largo plazo. Este artículo explora sistemáticamente las estrategias de diseño estructural de tres catalizadores representativos -Pt, Pd y Au- basadas en este concepto.

Fig. 2 Catalizadores de metales preciosos para la combustión de gases
2 Problemas comunes y mecanismos de disminución del rendimiento de los catalizadores de metales preciosos
2.1 Deficiencia del sitio activo y baja tasa de utilización
2.1.1 Adsorción de venenos y bloqueo de los sitios activos
Las impurezas de la reacción, como las especies que contienen azufre (por ejemplo, H₂S, compuestos organoazufrados) y cloro (por ejemplo, iones cloruro, organoclorados), pueden adsorberse fuertemente en los centros activos de las nanopartículas de metales nobles. Este proceso de quimisorción a menudo conduce a la formación de compuestos superficiales estables como el sulfuro de rodio (Rh₂S₃) o el cloruro de rodio (RhCl₃), que ocupan y desactivan permanentemente los sitios catalíticos. Además, la deposición de estas impurezas en el soporte del catalizador puede bloquear físicamente los mesoporos y microporos de los materiales de carbono, dificultando así la difusión de las moléculas reactivas hacia los sitios activos.
2.1.2 Aglomeración de partículas metálicas y degradación del soporte
Las nanopartículas de metales nobles (normalmente de 2-10 nm de tamaño) son susceptibles de migración y coalescencia durante los ciclos de reacción a alta temperatura, lo que conduce a la formación de grandes aglomerados de más de 50 nm. Este fenómeno de sinterización puede reducir la superficie electroquímicamente activa en más de un 75%. Al mismo tiempo, el propio soporte de carbono se degrada con la exposición prolongada a altas temperaturas, manifestándose como descomposición térmica, formación de grietas y pérdida de resistencia mecánica. Este colapso estructural del soporte acelera aún más la aglomeración de partículas metálicas y compromete la integridad global de la arquitectura del catalizador.
2.1.3 Disolución y desprendimiento inducidos por fluctuaciones del proceso
Las inestabilidades operativas, en particular cuando el potencial redox del sistema de reacción fluctúa más allá de la ventana de tolerancia del catalizador (normalmente ±0,3 V), pueden inducir la disolución anódica del metal noble en entornos ácidos. Este proceso genera especies iónicas solubles, como el Rh³⁺, que conducen a la pérdida irreversible del metal. Paralelamente, la exposición prolongada a condiciones muy ácidas o alcalinas puede provocar la hidrólisis o neutralización de los grupos funcionales de la superficie del soporte de carbono, debilitando la interacción metal-soporte y provocando el desprendimiento de las partículas activas.
2.1.4 Corrosión mediada por vapor y colapso de poros
En los sistemas que contienen vapor de agua, la condensación y permeación del vapor dentro de los nanoporos del soporte de carbono generan fuerzas capilares y tensión interfacial. Estas tensiones pueden provocar la microfractura y el colapso de la estructura de los poros. Simultáneamente, el vapor de agua puede interactuar con impurezas (por ejemplo, Cl-, SO₄²-) para formar un electrolito corrosivo localizado, que acelera la disolución de las nanopartículas metálicas y su posterior desprendimiento del soporte comprometido.
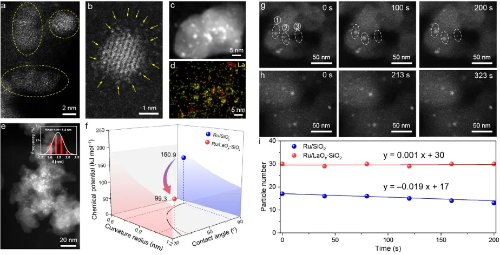
Fig. 3 Catalizadores isleños nanoestructurados para contrarrestar la sinterización de partículas
2.2 Sinterización y maduración Ostwald de las nanopartículas
La sinterización de nanopartículas metálicas soportadas representa una causa fundamental de desactivación a alta temperatura en catalizadores heterogéneos. Según los conocimientos convencionales, la sinterización se produce principalmente a través de dos mecanismos mediados por el sustrato: La maduración de Ostwald y la migración y coalescencia de partículas. Aunque las técnicas in situ avanzadas, como la microscopía electrónica de transmisión ambiental, han validado estas vías en condiciones de presión casi ambiente, los mecanismos de evolución dinámica de las nanopartículas en condiciones industriales extremas de alta temperatura y alta presión siguen sin comprenderse adecuadamente.
Investigaciones recientes que emplean simulaciones cinéticas reactivas de Monte Carlo combinadas con cálculos de la teoría del funcional de la densidad han revelado un mecanismo de salto y coalescencia de partículas (PHC) no reconocido hasta ahora en condiciones de alta presión de CO y temperatura elevada. Este proceso implica que las nanopartículas de Au se desprenden del soporte de TiO₂(101) anatasa, experimentan un "salto aéreo" a través de la migración en fase gaseosa y se fusionan con otras partículas. Una vez que los grupos fusionados superan un tamaño crítico, vuelven a depositarse en la superficie del soporte. Este comportamiento se debe a la fuerte interacción entre las moléculas de CO y los átomos de Au de la interfase cuando el potencial químico del CO es elevado y supera la energía de enlace entre la nanopartícula y el soporte.
Este mecanismo no sólo aclara las rápidas vías de desactivación de los catalizadores en condiciones de trabajo realistas, sino que también implica que la sinterización de las nanopartículas y la migración entre soportes pueden producirse con mucha más frecuencia y dinamismo de lo que se suponía hasta ahora. Los resultados proporcionan una nueva perspectiva teórica para entender la pérdida de estabilidad térmica en catalizadores industriales y establecen un marco metodológico para simular sistemas a nanoescala a través de escalas espaciales y temporales acopladas.

Fig. 4 Maduración de Ostwald
2.3 Envenenamiento de catalizadores de metales preciosos
El envenenamiento de los catalizadores de metales preciosos es un fenómeno en el que trazas de impurezas en el sistema de reacción ocupan o degradan irreversiblemente los sitios activos mediante quimisorción o reacciones químicas, lo que provoca una disminución significativa de la actividad y selectividad del catalizador. Representa una de las principales causas de desactivación en los catalizadores industriales.
2.3.1 Mecanismos y tipos de envenenamiento
Basándose en la naturaleza de la interacción entre el veneno y los sitios activos, el envenenamiento se suele clasificar en dos tipos:
A) Envenenamiento químico: El veneno interactúa fuertemente con los sitios activos a través de fuerzas químicas. Esta es la forma más común de envenenamiento.
- Envenenamiento por quimisorción fuerte: Las moléculas de veneno sufren una quimisorción irreversible o fuertemente reversible en los sitios activos, con energías de adsorción mucho mayores que las de los reactantes objetivo, bloqueando así físicamente los sitios. Por ejemplo, los compuestos que contienen azufre, fósforo y cianuro presentan una capacidad de adsorción muy fuerte en muchas superficies metálicas.
- Envenenamiento por efectos electrónicos: El veneno altera la estructura electrónica (por ejemplo, el centro de la banda d) de los centros activos de los metales preciosos donando o retirando electrones, lo que modifica su capacidad de adsorción de reactivos e impide la reacción catalítica.
- Envenenamiento por efectos estructurales: Ciertos venenos pueden inducir la reorganización de los átomos de la superficie, alterando la estructura geométrica original de los centros activos.
B) Envenenamiento físico/incrustación: El veneno en sí puede no interactuar químicamente con los centros activos, pero se deposita físicamente sobre los centros activos o en las bocas de los poros del soporte, dificultando la transferencia de masa de los reactivos.
2.3.2 Venenos comunes y sus mecanismos
Los distintos metales preciosos muestran diferentes sensibilidades a los distintos venenos. En la tabla siguiente se enumeran los venenos típicos y sus efectos:
Tabla 1 Venenos típicos
|
Categoría de veneno |
Sustancias representativas |
Catalizadores principalmente afectados |
Breve descripción del mecanismo |
|
Compuestos que contienen azufre |
H₂S, COS, SO₂, Mercaptanos, Tiofeno |
Pt, Pd, Rh, Ru |
Los átomos de S poseen electrones de par solitario, lo que permite una coordinación muy eficaz con los orbitales d de los metales preciosos, formando enlaces M-S estables. Se encuentran entre los venenos más comunes y potentes. |
|
Compuestos halogenados |
Cl-, HCl, Organoclorados |
Pt, Pd |
Los iones o átomos halógenos son altamente electronegativos y se adsorben fuertemente en las superficies metálicas, alterando el rendimiento catalítico a través de efectos electrónicos. A veces, pueden provocar la pérdida de metal al formar haluros volátiles. |
|
Compuestos de metales pesados |
Compuestos de Pb, Hg, As, Bi, Sn |
La mayoría de los catalizadores de metales preciosos |
Estos metales o sus iones tienen bajos potenciales de deposición en las superficies de metales preciosos y pueden cubrir permanentemente los sitios activos a través de reacciones irreversibles de desplazamiento o aleación de metales. |
|
Compuestos que contienen fósforo/nitrógeno |
PH₃, Fosfinas, Aminas, Cianuros |
Ni, Pd, Pt |
Al igual que los compuestos que contienen S, los átomos de P y N tienen una gran capacidad de coordinación y pueden formar enlaces de coordinación estables con centros activos. |
|
Hidrocarburos insaturados / Coque |
Alquenos, alquinos, precursores de coque |
La mayoría de los catalizadores metálicos |
Se someten a reacciones de polimerización y deshidrogenación a altas temperaturas, formando depósitos carbonosos de alto peso molecular que cubren físicamente los sitios activos y los poros. |
2.3.3 Factores que influyen en el grado de intoxicación
Naturaleza del veneno: La fuerza de adsorción, el impedimento estérico y los efectos electrónicos de la molécula de veneno con el sitio activo.
Propiedades del catalizador: La estructura electrónica de los distintos metales preciosos determina su resistencia al envenenamiento; por ejemplo, el Pt es sensible al CO, mientras que el Pd lo es al S. Las propiedades del soporte también influyen en la difusión y adsorción de los venenos.
Condiciones del proceso: Temperatura, presión, concentración de reactivo, etc. Por ejemplo, una temperatura elevada puede desorber ciertos venenos, pero también puede acelerar la coquización; una atmósfera reductora puede inhibir la adsorción de ciertos venenos oxidantes (por ejemplo, SO₂).
2.4 Disolución y lixiviación de metales
La disolución y la lixiviación de metales representan una vía de degradación crítica en electrocatálisis, que afecta especialmente a los catalizadores basados en platino y paladio en condiciones operativas. El mecanismo de disolución electroquímica implica procesos complejos dependientes del potencial en los que los átomos de metales nobles se oxidan en especies iónicas solubles. Por ejemplo, el platino sufre una oxidación secuencial para formar iones Pt²⁺ y Pt⁴⁺ que migran al electrolito, siguiendo una vía dinámica de disolución-redeposición en la que las especies disueltas se redepositan preferentemente en partículas de mayor tamaño o en regiones más catódicas. Este fenómeno se acelera significativamente en condiciones de ciclado de potencial, estando las velocidades de disolución fuertemente influenciadas por parámetros operacionales que incluyen ventanas de potencial, temperatura, pH y velocidades de barrido.
Los defectos estructurales son los principales lugares de inicio de la disolución, donde las esquinas, los bordes y los lugares de dislocación muestran una mayor susceptibilidad al ataque oxidativo. Estudios avanzados in situ revelan que las nanoestructuras con núcleo en cáscara, como los nanocubos de Pd@Pt, experimentan una degradación exacerbada a través de mecanismos de corrosión galvánica y corrosión inducida por haluros, que comienzan en la interfaz núcleo-cáscara y se propagan hacia el exterior. Al mismo tiempo, la corrosión del material de soporte, en particular la degradación del soporte de carbono bajo potenciales y temperaturas elevados, agrava aún más la pérdida de metal al debilitar el anclaje de las partículas.
Las estrategias de mitigación se centran en mejorar la estabilidad termodinámica de los átomos metálicos mediante la modulación de la estructura electrónica. La aleación de platino con elementos más nobles, como el oro, demuestra una eficacia notable, ya que la incorporación de Au eleva el potencial de inicio de la disolución y reduce las tasas de disolución en aproximadamente un 40% mediante la donación de electrones que aumenta la nobleza del platino. Las arquitecturas de núcleo-cáscara que utilizan materiales de núcleo más baratos (por ejemplo, Pd) reducen simultáneamente el uso de metales preciosos al tiempo que introducen una tensión de compresión para mejorar la estabilidad de la cáscara. Alternativamente, la dispersión a escala atómica a través de catalizadores monoatómicos anclados en soportes modificados (p. ej., Pt sobre CeO₂ dopado con Zr) consigue una estabilidad excepcional, manteniendo la integridad estructural incluso bajo duras condiciones hidrotermales a 800°C al evitar la migración de partículas y la sinterización.
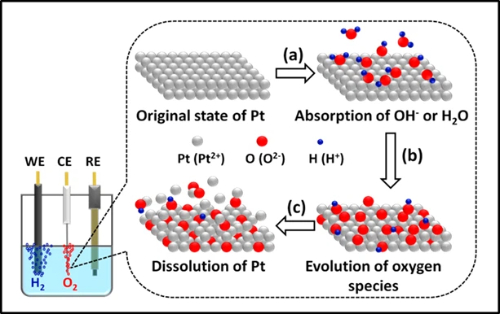
Fig. 5 Fenómeno de disolución del platino en el proceso electroquímico de división del agua para la producción de hidrógeno.
2.5 Pérdida de control de la selectividad
El control preciso de las vías de reacción representa un reto fundamental en las reacciones complejas de múltiples pasos, en las que los catalizadores basados en paladio presentan con frecuencia una selectividad comprometida debido a una energética de adsorción intermedia no optimizada. El mecanismo subyacente que rige la selectividad radica en la estructura electrónica de los sitios activos, en particular la posición del centro de la banda d, que determina la fuerza de adsorción de reactivos e intermedios. En la reducción electroquímica de nitrilos a aminas primarias, los catalizadores de Pd convencionales muestran una fuerza de adsorción excesiva hacia los intermedios *CH₃CN, promoviendo vías de reducción profunda no deseadas y reacciones secundarias de evolución de hidrógeno que, en conjunto, disminuyen la eficiencia faradáica hacia los productos objetivo.
Las estrategias avanzadas de diseño de catalizadores abordan con éxito estas limitaciones mediante la manipulación precisa de las estructuras electrónicas y geométricas de la superficie. La ingeniería de la deformación reticular ejemplifica este enfoque, en el que los aerosoles metalénicos de Pd@Pd-Cu logran una notable selectividad de etilamina del 95,38% mediante la introducción de una deformación compresiva controlada que sintoniza de forma óptima la posición central de la banda d y la fuerza de adsorción intermedia. La incorporación de cobre genera superficies de paladio tensadas con precisión que equilibran la activación de *CH₃CN y la estabilización intermedia de *CH₃CH=NH, suprimiendo eficazmente las vías competidoras.
Otra innovación surge de los principios de diseño de alta entropía, donde el metaleno de alta entropía PdRhFeCoMo altera la simetría convencional del sitio mediante el desorden configuracional. Este "efecto cóctel" crea entornos de coordinación locales únicos que mejoran significativamente la adsorción de etanol y la capacidad de escisión del enlace C-C, logrando una selectividad sin precedentes de la vía C1 del 84,12% en la oxidación del etanol, al tiempo que mejora la resistencia al envenenamiento mediante un comportamiento modificado del hidrógeno superficial.
La sinergia bimetálica proporciona dimensiones adicionales para la optimización de la selectividad, como demuestran los aerosoles de metaleno Pt-Pd en los que la incorporación de platino modula el centro de la banda d del paladio para crear catalizadores de doble función capaces de promover simultáneamente la oxidación anódica del etanol y la evolución catódica del hidrógeno. Esta optimización de la estructura electrónica equilibra la energía de adsorción de los diferentes intermediarios a través de múltiples reacciones, permitiendo procesos en cascada eficientes.
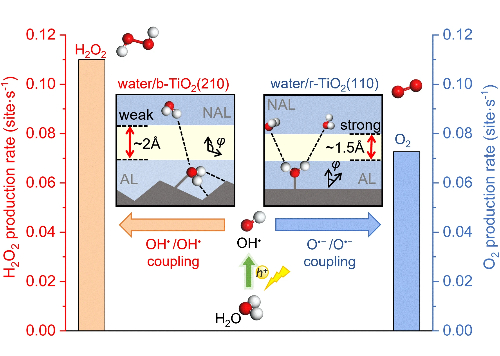
Fig. 6 Control selectivo de la oxidación fotocatalítica del agua
3 Tres soluciones específicas para cada material
3.1 Aproximación a las soluciones catalíticas basadas en el platino
Los catalizadores basados en platino (Pt ) son esenciales para la reacción de reducción de oxígeno (ORR) en el cátodo de las pilas de combustible de membrana de intercambio protónico (PEMFC), pero su comercialización generalizada sigue viéndose obstaculizada por tres retos fundamentales: la lenta cinética ORR, el alto coste debido a la escasez de Pt y la degradación estructural -incluyendo la disolución, migración y sinterización de las nanopartículas de Pt- en condiciones de funcionamiento dinámicas como los ciclos de potencial y el alto voltaje. Para hacer frente a estas limitaciones, se han desarrollado estrategias avanzadas de diseño de materiales, centradas principalmente en los tres enfoques siguientes.

Fig. 7 Mejora de la estabilidad de los catalizadores de platino para pilas de combustible
Solución 1: Aleaciones de Pt-M y estructuras Core-Shell
Este enfoque consiste en adaptar la estructura electrónica del Pt mediante la introducción de metales de transición (M), lo que mejora tanto la actividad catalítica como la durabilidad, al tiempo que reduce la carga de Pt.
Descripción de la estrategia:
Las nanopartículas de aleación basadas en Pt -que incorporan metales de transición como Ni, Co, Fe o Cu- se sintetizan mediante métodos químicos húmedos o de sustitución galvánica. Alternativamente, se construyen arquitecturas núcleo-cáscara (por ejemplo, Pd@Pt) o estructuras Pt-cáscara, en las que una cáscara rica en Pt encierra un material núcleo más asequible como el Pd o un metal no noble.
Mecanismo de acción:
Efecto electrónico (ligando): La transferencia de electrones de los metales de transición al Pt desplaza hacia abajo el centro de la banda d del Pt, optimizando la energía de adsorción de los compuestos intermedios que contienen oxígeno (por ejemplo, O y OH) y acelerando así la cinética de la ORR. Por ejemplo, la superficie Pt3Ni(111) presenta una actividad ORR diez veces superior a la del Pt(111).
Efecto geométrico (deformación): El desajuste de la red entre el núcleo y la capa de Pt induce una deformación por compresión, que afina aún más la estructura electrónica del Pt y mejora su rendimiento catalítico.
Ventaja económica:
Al concentrar el Pt en la capa superficial, las estructuras core-shell maximizan la eficiencia de utilización del Pt, reduciendo significativamente el coste global del catalizador.
Solución 2: Control de la morfología y exposición de facetas de alto índice
Esta estrategia se centra en dar forma a los nanocristales de Pt para exponer facetas cristalinas altamente activas, mejorando la actividad másica sin alterar la composición química.
Descripción de la estrategia:
Mediante técnicas de síntesis coloidal con tensioactivos y cinética de reducción cuidadosamente controlados, se producen nanoestructuras de Pt bien definidas, como nanocubos (facetas {100}), octaedros (facetas {111}) y estructuras dendríticas.
Mecanismo de acción:
Facetas de alta actividad: Las facetas de alto índice (por ejemplo, {730}, {510}) poseen una alta densidad de átomos escalonados y acodados, que sirven como sitios activos altamente insaturados. Estos sitios facilitan la escisión del enlace O-O y la desorción intermedia, lo que conduce a una actividad ORR intrínseca superior.
Integridad estructural: Ciertas arquitecturas, como los nanoarmazones y las nanoestructuras ramificadas, proporcionan estructuras robustas que resisten la migración y la coalescencia de partículas, mejorando así la estabilidad catalítica.
Solución 3: Soportes estables y fuerte interacción metal-soporte
Este enfoque pretende mitigar la corrosión del soporte de carbono -una de las principales causas del desprendimiento y la degradación de las nanopartículas de Pt- empleando materiales portadores robustos y funcionalizados.
Descripción de la estrategia:
Los soportes de carbono convencionales se sustituyen por materiales avanzados, entre los que se incluyen:
Carbones grafíticos (por ejemplo, grafeno, nanotubos de carbono), conocidos por su alta conductividad eléctrica y resistencia a la corrosión;
Carbones dopados con heteroátomos (por ejemplo, dopados con N, B o P), que mejoran la interacción metal-soporte y modifican las propiedades electrónicas;
Óxidos/carburos metálicos (por ejemplo, TiO2, SnO2, TiC), que ofrecen una excelente estabilidad en condiciones oxidantes.
Mecanismo de acción:
Fuerte interacción metal-soporte (SMSI): Los grupos funcionales o defectos de la superficie del soporte forman fuertes enlaces covalentes (por ejemplo, Pt-O-Ti) con las nanopartículas de Pt, suprimiendo eficazmente la migración de partículas, la maduración de Ostwald y el desprendimiento.
Mayor durabilidad: La estabilidad electroquímica superior de estos soportes en condiciones de alto potencial minimiza la pérdida de Pt inducida por la corrosión, alargando así la vida útil del catalizador.
Tabla 1 Cuadro comparativo de soluciones catalizadoras a base de platino
|
Soluciones |
Estrategias básicas |
Mecanismos de mejora de la actividad |
Mecanismos para mejorar la estabilidad |
Rentabilidad |
Retos clave |
|
Aleaciones Pt-M y estructuras Core-Shell |
Regulación de la composición y la estructura |
Los efectos del ligando y de la deformación optimizan conjuntamente los centros de la banda d del Pt, reduciendo la barrera de energía ORR. |
Los elementos de aleación o las capas del núcleo mejoran el potencial de disolución del Pt mediante efectos de soporte; ciertos elementos de aleación (p. ej., Ni) forman estructuras Pt-skin en el momento de la disolución, mejorando la estabilidad de la superficie. |
Alta (reduce significativamente el consumo de Pt) |
Los metales de transición pueden lixiviarse en entornos ácidos, lo que provoca una disminución de la actividad y el ensuciamiento de las membranas; los procesos de fabricación de estructuras core-shell son complejos. |
|
Control de la morfología y planos cristalinos de alto índice |
Ingeniería de superficies |
La exposición de planos cristalinos de alto índice con átomos de coordinación insaturados de alta densidad proporciona sitios activos altamente intrínsecos. |
Las estructuras interconectadas con morfologías específicas (por ejemplo, dendritas, nanoestructuras) suprimen la migración de partículas. |
Moderado (alta utilización de Pt pero coste de síntesis relativamente alto) |
Los planos cristalinos de alto índice suelen ser inestables en condiciones de reacción y se reconstruyen fácilmente en planos de baja energía; existen dificultades para lograr una síntesis escalable y reproducible. |
|
Soportes estables con fuertes interacciones metal-soporte |
Ingeniería de soportes |
Los soportes de carbono dopados pueden modular la estructura electrónica del Pt mediante efectos electrónicos; mejoran la transferencia de masa. |
Las fuertes interacciones anclan las partículas de Pt; los soportes muy estables resisten la corrosión y evitan el desprendimiento de partículas. |
Moderado (el coste del portador puede aumentar, pero prolonga la vida útil). |
Algunos soportes muy estables (p. ej., óxidos metálicos) presentan una conductividad deficiente, lo que puede aumentar la resistencia interfacial; se requiere un control preciso de los mecanismos de interacción metal-soporte. |
3.2 Soluciones catalizadoras a base de paladio
Los catalizadores basados en paladio (Pd) son fundamentales en la síntesis de química fina, especialmente en las reacciones de acoplamiento cruzado y de hidrogenación/oxidación selectiva. Sin embargo, su aplicación práctica se ha visto constantemente limitada por tres grandes retos: la dificultad de recuperar y reutilizar catalizadores de Pd homogéneos a pesar de su alta selectividad; la falta de uniformidad de los sitios activos en los catalizadores de Pd heterogéneos, que provoca problemas como la lixiviación y la desactivación inducida por la sinterización; y la gran dificultad para lograr un control preciso de la selectividad química, regio y estereoselectiva. Para abordar simultáneamente la actividad, la estabilidad y la selectividad, se han desarrollado las siguientes estrategias avanzadas.
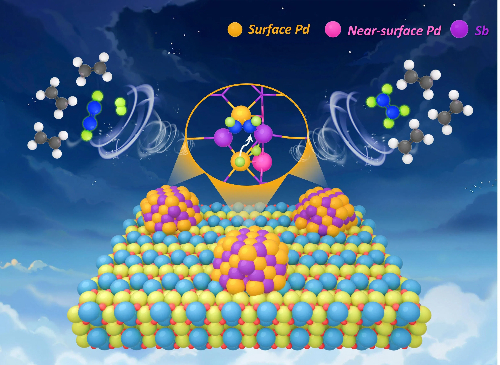
Fig. 8 Lugar de hidrogenación de alquenos en catalizadores de paladio
Solución 1: catalizadores de átomo único
Este enfoque implica estabilizar el Pd como átomos aislados para crear sitios activos estructuralmente uniformes, ofreciendo una vía ideal hacia la máxima selectividad y eficiencia atómica.
Descripción de la estrategia:
Los átomos individuales de Pd se anclan en soportes ricos en defectos -como óxidos metálicos (CeO2, TiO2), nitruro de carbono (g-C3N4) o carbono dopado con nitrógeno (N-C)- mediante métodos que incluyen la adsorción electrostática fuerte, la coprecipitación o la pirólisis a alta temperatura.
Mecanismo de acción:
Eficiencia atómica maximizada y sitios activos uniformes: Cada átomo de Pd sirve como sitio activo independiente y estructuralmente idéntico, logrando un aprovechamiento atómico casi teórico. Esta uniformidad elimina las reacciones secundarias causadas por sitios activos heterogéneos, lo que permite una selectividad del producto objetivo excepcionalmente alta.
Estabilidad mejorada: Las fuertes interacciones covalentes entre los átomos de Pd y los heteroátomos (p. ej., O, N) en la superficie del soporte inmovilizan eficazmente las especies de Pd, suprimiendo la migración, la aglomeración y la lixiviación, mejorando así la durabilidad catalítica a lo largo de múltiples ciclos.
Solución 2: Nanoclusters y catálisis de confinamiento
Esta estrategia se centra en el control preciso del número de átomos de Pd y la explotación del confinamiento espacial para adaptar el comportamiento catalítico a escala subnanométrica, permitiendo la selectividad a nivel molecular.
Descripción de la estrategia:
Los grupos de Pd con nuclearidad bien definida (por ejemplo, Pd4, Pd8) se sintetizan mediante métodos coloidales o químicos precisos. Alternativamente, las especies de Pd se encapsulan dentro de las estructuras porosas ordenadas de las zeolitas o las estructuras metalorgánicas (MOF) mediante la síntesis "barco en botella".
Mecanismo de acción:
Efectos del tamaño cuántico: A escala subnanométrica, el Pd presenta estructuras electrónicas discretas que difieren tanto de los átomos individuales como de las nanopartículas de mayor tamaño, lo que da lugar a propiedades catalíticas únicas y a la activación de vías de reacción específicas.
Confinamiento espacial y catálisis de forma selectiva: Los entornos de poros confinados de las zeolitas o los MOF actúan como nanorreactores, que:
Admiten selectivamente reactivos y liberan productos en función del tamaño y la forma molecular (selectividad por tamaño),
Restringen las geometrías de los estados de transición para controlar la estereoquímica de la reacción (estereoselectividad),
Aislar físicamente los grupos de Pd para evitar la agregación y el crecimiento.
Solución 3: Formación in situ de nanopartículas de Pd en fase líquida
Este enfoque aprovecha un sistema catalítico dinámico en el que las especies activas de Pd se generan in situ, combinando el alto rendimiento de la catálisis homogénea con la fácil recuperación de la catálisis heterogénea.
Descripción de la estrategia:
Se introducen precursores de Pd solubles (por ejemplo, Pd(OAc)2) o complejos estabilizados por ligando en la mezcla de reacción, donde se reducen in situ en condiciones de reacción para formar nanopartículas o nanoclusters de Pd altamente activos sobre el soporte o dentro del medio líquido.
Mecanismo de acción:
Sinergia entre catálisis homogénea y heterogénea: Las nanopartículas de Pd formadas in situ son pequeñas, defectuosas y muy activas, asemejándose en su rendimiento a los catalizadores homogéneos. Tras la reacción, estas especies pueden transformarse en formas menos activas o insolubles (por ejemplo, mediante oxidación o aglomeración), lo que permite una separación y un reciclado sencillos similares a los de los sistemas heterogéneos.
Mitigación de la desactivación: Este proceso dinámico resuelve la disyuntiva entre estabilidad y actividad: durante la reacción se forman pequeñas partículas muy activas, mientras que después de la reacción se adopta un estado más estable, lo que minimiza la sinterización irreversible y la desactivación durante la reutilización.
Tabla 2 Tabla comparativa horizontal de soluciones catalizadoras basadas en paladio
|
Solución |
Estrategia central |
Selectividad Resistencia |
Estabilidad Mecanismo |
Utilización de átomos |
Escenarios aplicables |
|
Catalizadores de átomo único |
Dispersión atómica y homogeneización estructural |
Química y estereoselectividad |
Fuerte unión metal-soporte |
~100% |
Hidrogenación selectiva, oxidación de CO |
|
Nanoclusters y catálisis confinada |
Nuclearidad precisa y confinamiento espacial |
Tamaño y estereoselectividad |
El confinamiento físico evita la aglomeración |
Alta |
Síntesis quiral, reacciones de forma selectiva |
|
Formación in situ de nanopartículas de Pd |
Formación dinámica de especies activas |
Selectividad química |
El equilibrio dinámico reduce la sinterización |
Alta durante la reacción, requiere reactivación |
Síntesis química fina reciclable |
3.3 Soluciones catalíticas a base de oro
Eloro (Au), aunque químicamente inerte en su forma a granel, demuestra una actividad catalítica excepcional cuando se diseña a nanoescala y con el soporte adecuado, un descubrimiento transformador que ha reconfigurado la catálisis moderna. Sin embargo, la aplicación práctica de catalizadores basados en oro se enfrenta a tres grandes retos: la inercia intrínseca del Au a granel; la fuerte tendencia de las nanopartículas de Au a sinterizarse o a sufrir la maduración de Ostwald en condiciones de reacción, lo que provoca una rápida desactivación; y la sensibilidad a la humedad y a ciertas especies tóxicas. Para superar estas limitaciones y liberar todo el potencial de los nanocatalizadores de Au, se han desarrollado varias estrategias avanzadas de diseño, que se describen a continuación.
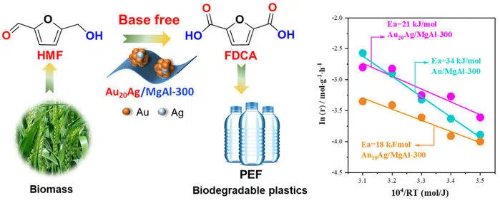
Fig. 9 Catalizadores de oro para la bioconversión
Solución 1: Control del tamaño e ingeniería del soporte
Este enfoque aprovecha los efectos cuánticos y las interacciones del soporte para activar las nanopartículas de Au controlando con precisión su tamaño y estado de dispersión.
Descripción de la estrategia:
Se sintetizan nanopartículas de oro de menos de 5 nm, óptimamente de 2-3 nm, mediante métodos como la deposición-precipitación o la síntesis coloidal, y se depositan sobre soportes de óxidos metálicos reducibles como TiO2, Fe2O3 y CeO2.
Mecanismo de acción:
Efectos del tamaño cuántico: A medida que el tamaño de las partículas de Au disminuye por debajo de ∼5 nm, su estructura electrónica pasa de metálica a no metálica, lo que da lugar a una elevada proporción de átomos superficiales subcoordinados (por ejemplo, escalones, bordes). Estos sitios presentan una mayor capacidad de adsorción y activación de moléculas pequeñas como el CO y el O2, constituyendo el origen fundamental de la actividad catalítica del Au.
Activación mediada por soporte: Ciertos soportes de óxidos metálicos no sólo estabilizan las nanopartículas de Au, sino que también participan directamente en los ciclos catalíticos. Por ejemplo, en la oxidación del CO mediante el mecanismo de Mars-van Krevelen, el oxígeno reticular del soporte (por ejemplo, CeO2) reacciona con el CO, mientras que el O2 en fase gaseosa repone las vacantes de oxígeno, creando un ciclo catalítico sinérgico entre el Au y el soporte.
Solución 2: Interfaz Au-soporte y sitios bifuncionales
Esta estrategia se centra en el diseño deliberado de sitios interfaciales entre las nanopartículas de Au y el soporte, donde se produce la catálisis sinérgica.
Descripción de la estrategia:
Mediante un cuidadoso control de los parámetros de síntesis -como la selección de la faceta del soporte, la temperatura de calcinación y la atmósfera-, las nanopartículas de Au se dispersan finamente para maximizar la densidad y la estabilidad de los sitios interfaciales Au-soporte.
Mecanismo de acción:
Catálisis bifuncional interfacial: En reacciones clave como la oxidación de CO a baja temperatura, el sitio activo suele estar situado en el perímetro Au-soporte. Aquí, el Au facilita la adsorción y activación del CO, mientras que el soporte adyacente activa el O2 (o H2O). Esta división espacial y funcional del trabajo reduce significativamente la barrera de activación y mejora la velocidad de reacción mediante una interacción sinérgica.
Solución 3: Aleación y modificación de la superficie
Este enfoque mejora tanto la actividad como la estabilidad de los catalizadores de Au mediante la introducción de un segundo metal u óxido modificador para adaptar las propiedades electrónicas y estructurales.
Descripción de la estrategia:
El Au se alea con otros metales (p. ej., Pd, Pt, Ag) o se modifica en superficie con óxidos metálicos (p. ej., FeOx, TiOx) para formar nanopartículas de aleación o arquitecturas core-shell y decoradas.
Mecanismo de acción:
Modulación electrónica: La introducción de un segundo elemento altera la densidad electrónica de los átomos de Au a través de los efectos del ligando, afinando la fuerza de adsorción de los intermedios y ampliando el alcance de la reacción más allá de lo que puede conseguir el Au puro.
Estabilización estructural: El componente secundario actúa como espaciador físico, inhibiendo el contacto directo y la coalescencia de las partículas de Au durante el tratamiento térmico o la reacción, mejorando así la resistencia a la sinterización y la longevidad operativa.
Tabla 3 Tabla comparativa horizontal de soluciones catalizadoras a base de oro
|
Soluciones |
Estrategia central |
Sitio activo |
Mecanismo de mejora de la estabilidad |
Ventajas |
Principales retos |
|
Efecto del tamaño y selección del portador |
Control del tamaño de las partículas (<5 nm) mediante portadores específicos |
Átomos de baja coordinación en la superficie de pequeñas partículas de Au; sitios de activación que participan en el portador |
Los portadores proporcionan sitios de anclaje, suprimiendo la migración de partículas |
Alta actividad intrínseca, diversas opciones de portadores y estudios en profundidad del mecanismo. |
Inestabilidad termodinámica de las partículas pequeñas, propensas a la sinterización; fuerte dependencia de las propiedades del portador. |
|
Construcción de la interfaz Au-soporte |
Control preciso de la interfaz de contacto entre el Au y el soporte |
Sitios de doble función en la interfaz Au-soporte |
Las fuertes interacciones metal-soporte estabilizan las partículas de Au |
Aprovechamiento completo de los efectos sinérgicos entre el oro y el soporte, con sitios activos bien definidos |
La estructura de la interfaz puede reconfigurarse durante las reacciones, lo que exige una alta reproducibilidad en la preparación |
|
Aleación y modificación de la superficie |
Introducción de un segundo componente para regular las estructuras electrónicas y geométricas |
Átomos de Au cerca de superficies de aleación o capas modificadas |
El segundo componente actúa como barrera física, impidiendo que las partículas de Au entren en contacto con las capas sinterizadas |
Mejora simultáneamente la actividad y la estabilidad térmica con gran capacidad de ajuste |
Puede introducir costes o complejidad; el segundo componente puede segregarse o lixiviarse. |
4 Comparación general y perspectivas
4.1 Comparación exhaustiva
Mediante un análisis en profundidad de los tres catalizadores clave de metales preciosos -platino (Pt), paladio (Pd) y oro (Au)- podemos resumir sistemáticamente sus características y soluciones, destilando principios de diseño comunes y futuras direcciones de desarrollo.
Tabla 4 Comparación exhaustiva de los tres catalizadores de metales preciosos
|
Material |
Aplicación principal |
Problema principal |
Solución principal |
Efecto y características |
|
Pt |
Electrocatálisis |
Coste, actividad, estabilidad |
Control de aleación/núcleo-cáscara/morfología |
Mejora de la actividad intrínseca, reducción de la dosificación |
|
Pd |
Síntesis química |
Selectividad, recuperación, desactivación |
Átomo único/Clúster/Confinado |
Permite una síntesis precisa y una fácil separación |
|
Au |
Catálisis medioambiental |
Intrínsecamente inerte, propenso a la sinterización |
Control dimensional/Ingeniería de interfaces |
Activa el rendimiento, mejora la estabilidad térmica |
4.2 Extracción de principios universales de diseño
Aunque los tres catalizadores se enfrentan a retos distintos, sus soluciones revelan principios comunes en el diseño de materiales catalíticos:
La ingeniería interfacial es universalmente crítica: ya sea en las interfaces Pt-soporte, Au-soporte o Pd-soporte, estas regiones son fundamentales para construir una catálisis sinérgica, potenciar las interacciones metal-soporte y mejorar la estabilidad. Las interfaces son el principal campo de batalla para superar las limitaciones de los materiales individuales.
La modulación de la estructura electrónica es fundamental para mejorar la actividad intrínseca: La modulación de los centros de la banda d de los sitios activos mediante aleación, dopaje, ingeniería de la deformación y otros medios para optimizar las barreras energéticas de adsorción/desorción de los intermediarios de reacción representa una estrategia universal para superar los cuellos de botella de la actividad catalítica.
El control de la estructura geométrica es una poderosa herramienta para estabilizar los catalizadores y regular la selectividad: El control preciso de la disposición geométrica de los sitios activos -desde átomos individuales y nanoclusters hasta planos cristalinos de alto índice- puede mejorar simultáneamente la actividad aumentando el número de átomos de baja coordinación y dirigiendo con precisión las vías de reacción y la selectividad mediante efectos de impedimento estérico y confinamiento.
4.3 Perspectivas de futuro
De cara al futuro, la investigación sobre catalizadores de metales preciosos avanza hacia una nueva fase caracterizada por una profunda integración multidisciplinar, enfoques basados en datos y un fuerte énfasis en el desarrollo sostenible.
La integración entre sistemas de materiales y la polinización cruzada de filosofías de diseño se perfilan como direcciones clave. Por ejemplo, aplicar a los sistemas de paladio el concepto maduro de estructura de concha central de los catalizadores basados en platino podría reducir aún más el consumo y los costes de los catalizadores. Por otra parte, el empleo de sofisticadas estrategias de ingeniería interfacial a partir de catalizadores basados en el oro para mejorar la durabilidad de los electrocatalizadores basados en el platino podría dar lugar a nuevos sistemas catalíticos de alto rendimiento a través de esta fertilización cruzada de ideas.
La evolución sinérgica de la inteligencia artificial y las técnicas avanzadas de caracterización transformará profundamente los paradigmas de I+D: Por un lado, el aprendizaje automático potenciará el cribado virtual de alto rendimiento, identificando rápidamente soluciones óptimas a partir de vastas combinaciones de composición, estructura y soportes para lograr una "personalización a la carta" de los catalizadores. Por otro lado, los avances en técnicas de caracterización in situ/operativas, como la radiación sincrotrón y la microscopía electrónica de barrido ambiental, permitirán observar a escala atómica y en tiempo real la evolución estructural dinámica en entornos de reacción reales. Este enfoque unificado revelará la naturaleza de los sitios activos y los mecanismos de desactivación, guiando un diseño racional más específico.
En última instancia, todos estos avances tecnológicos deben servir al gran objetivo del desarrollo sostenible. Esto significa que las tecnologías ecológicas de reciclaje de metales preciosos y el establecimiento de sistemas económicos circulares adquirirán la misma importancia que el diseño del rendimiento de los propios catalizadores. Al mismo tiempo, el desarrollo de catalizadores alternativos con cargas ultrabajas de metales preciosos o incluso alternativas totalmente exentas de metales preciosos será la vía fundamental para hacer frente a las limitaciones de recursos y lograr un desarrollo a largo plazo en los sectores químico y energético.

Fig. 10 Aplicaciones de los catalizadores de metales preciosos
Socio para soluciones catalíticas avanzadas
Stanford Advanced Materials (SAM) suministra catalizadores y soportes de alta pureza de Pt, Pd y Au, adaptados a sus necesidades de I+D e industriales. Póngase en contacto con nuestro equipo técnico para estudiar soluciones personalizadas.
Referencia
[1] Zandkarimi, B.; Poths, P.; Alexandrova, A. N. When Fluxionality Beats Size Selection: Acceleration of Ostwald Ripening of Sub-Nano Clusters. Angew. Chem. Int. Ed. 2021, *60* (11), 5701-5704. DOI: 10.1002/anie.202100107.
[2] Zhang, S.; Han, Y.; Zhu, B.; Gao, Y. Particle Hopping and Coalescence of Supported Au Nanoparticles in Harsh Reactive Environments. J. Am. Chem. Soc. 2025. DOI: 10.1021/jacs.5c03633.
[3] Liu, L.; Lu, J.; Wang, L.; Xiao, F.-S. Dealuminated Beta zeolite reverses Ostwald ripening for durable copper nanoparticle catalysts. Science 2023, *382* (6673), 771-776. DOI: 10.1126/science.adj1962.
[4] Li, W.; Ouyang, R. Stability of Nanocatalysts under Reaction Conditions: A Theoretical Study. J. Am. Chem. Soc. 2013, *135* (5), 1760-1771. DOI: 10.1021/ja3087054.
[5] Li, W., & Ouyang, R. (2013). Stability of Nanocatalysts under Reaction Conditions: A Theoretical Study. Journal of the American Chemical Society, 135(5), 1760-1771. DOI: 10.1021/ja3087054.
[6] Yin, P., Hu, S., Liang, H., & Li, W. (2021). Quantification of critical particle distance for mitigating catalyst sintering. Nature Communications, 12, 4865. DOI: 10.1038/s41467-021-25116-2.

 Bares
Bares
 Cuentas y esferas
Cuentas y esferas
 Tornillos y tuercas
Tornillos y tuercas
 Crisoles
Crisoles
 Discos
Discos
 Fibras y tejidos
Fibras y tejidos
 Películas
Películas
 Escama
Escama
 Espumas
Espumas
 Folio
Folio
 Gránulos
Gránulos
 Panales
Panales
 Tinta
Tinta
 Laminado
Laminado
 Bultos
Bultos
 Mallas
Mallas
 Película metalizada
Película metalizada
 Placa
Placa
 Polvos
Polvos
 Varilla
Varilla
 Hojas
Hojas
 Cristales individuales
Cristales individuales
 Blanco para sputtering
Blanco para sputtering
 Tubos
Tubos
 Lavadora
Lavadora
 Cables
Cables
 Conversores y calculadoras
Conversores y calculadoras
 Escriba para nosotros
Escriba para nosotros



 Dr. Samuel R. Matthews
Dr. Samuel R. Matthews


